X連鎖性低リン血症 (XLH) の現状と抗FGF23抗体療法 ―小児患者について―
Pharma Medica 37(6):71-75, 2019
はじめに
線維芽細胞増殖因子23 (fibroblast growth factor-23:FGF23) は,骨細胞で産生されるホルモンで,腎の近位尿細管においてリンの再吸収を阻害するとともに,血中1,25-水酸化ビタミンD[1,25 (OH)₂D]の低下を介して腸管リン吸収の抑制させることにより,血中リン濃度を低下させる(図1)1)。
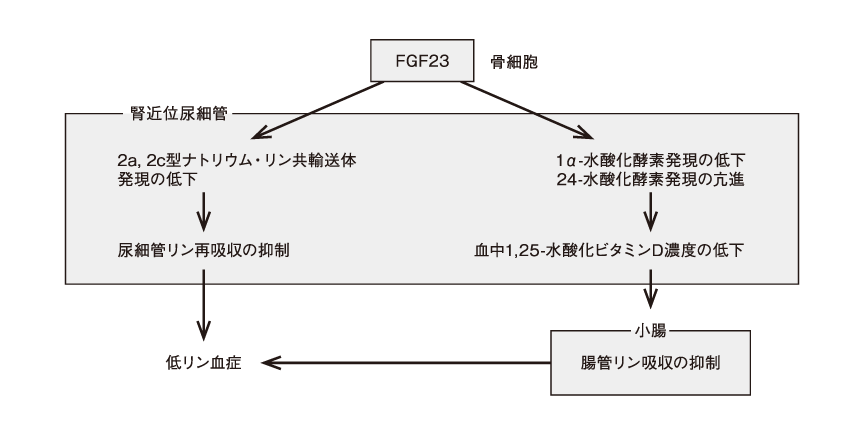
図1 FGF23作用過剰による低リン血症の機序
(木下祐加: BONE. 2016; 30 : 367-73.)
このため,FGF23の作用が過剰となると,FGF23関連低リン血症性くる病・骨軟化症が引き起こされる(表1)1)。逆に,FGF23作用障害による疾患として頻度は低いが,高リン血症性家族性腫瘍状石灰沈着症 (hyperphosphatemic familial tumoral calcinosis:HFTC) が知られている1)。
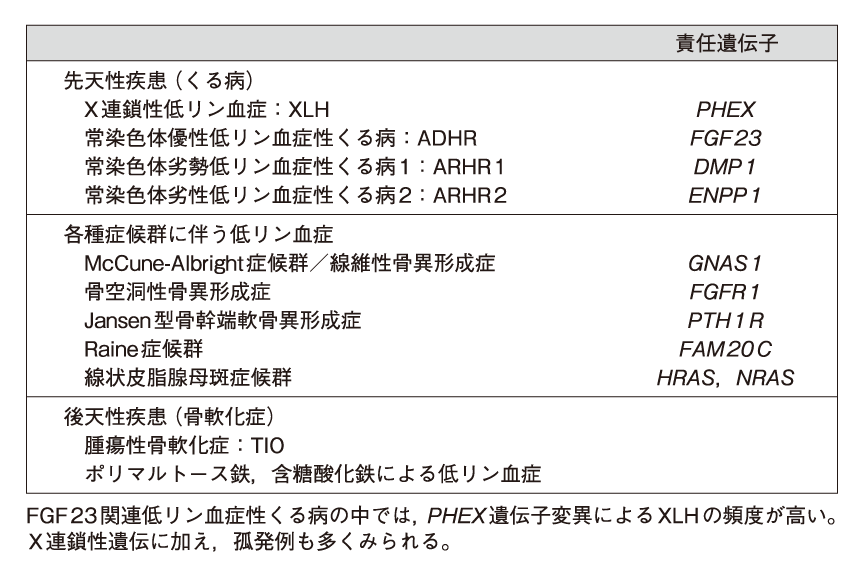
表1 FGF23関連低リン血症疾患の病因
(木下祐加: BONE. 2016; 30 : 367-73. 一部改変)
FGF23作用過剰に基づく疾患で頻度が高いものは,先天性のX連鎖性低リン血症 (X-linked dominant hypophosphatemia:XLH) ,および後天性の腫瘍性骨軟化症 (tumor-induced osteomalacia:TIO) である。XLHは,X染色体上のphosphate-regulating endopeptidase homolog, X-linked (PHEX) 遺伝子の機能喪失型変異が原因となる2)。TIOは,骨や軟部組織に生じるFGF23産生腫瘍により低リン血症をきたす疾患であり,診断された年齢の中央値は40〜45歳である3)。
PHEX遺伝子変異がXLH発症にどのように関与しているかについては,解明すべき点が多い。重症度については,遺伝子がX染色体上に位置するため2),男性患者はすべて重症となるが,女性患者ではX染色体上のいずれのPHEX遺伝子が活性化するかは,ランダムに決定されるため,ヘテロ接合である場合に正常遺伝子が活性化すれば軽症となり,変異遺伝子が活性化すれば重症となる。
本稿では,小児のFGF23関連低リン血症の診断と治療などについて概観し,さらに,最近欧米で臨床適用が承認された抗FGF23抗体製剤の可能性などについて述べる。
なお,くる病および骨軟化症の呼称については,骨端線の閉鎖前に発症した場合はくる病,骨端線の閉鎖後に発症した場合は骨軟化症とされる。
FGF23関連低リン血症性くる病・骨軟化症の疫学と診断
2010年にわが国で行われた,FGF23関連低リン血症性疾患の発症率を推定した疫学研究では,FGF23関連低リン血症全体の年間発症例数は117例,XLHの推定発症率は2万人に1人とされたが4),この発症率は北米の研究結果と大きく異なるものではない。
当施設でXLHと診断される患者は,年間1〜2例であるが,そのほとんどが小児科または整形外科からの紹介患者である。紹介患者は,下肢変形(O脚)や歩行時の異常所見からくる病として送られてくることが多く,紹介患者の年齢は1.5歳〜2歳が多数で,1歳以下の患者は多くない。
わが国の「くる病・骨軟化症の診断マニュアル」5)では,くる病・骨軟化症の病因鑑別のためのフローチャートが示され,FGF23関連低リン血症の診断基準として血清リン低値に加え,血清FGF23が30pg/mL未満であれば,FGF23関連低リン血症の可能性が高いとしているが(図2),血清FGF23測定の検査薬は,わが国で製造販売承認が取得されているものの保険収載はされていない(2019年3月現在)※1。
※1:FGF23測定の保険適用 2019年10月
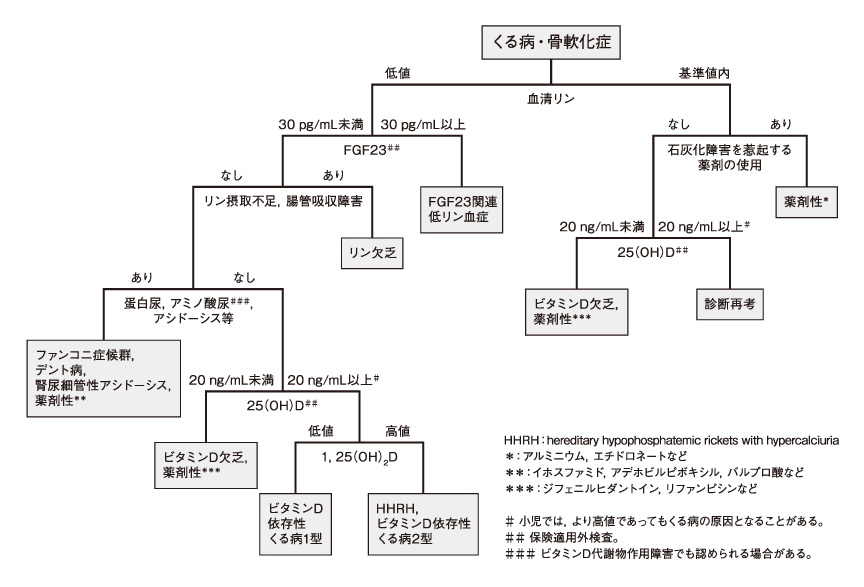
図2 くる病・骨軟化症の病因鑑別フローチャート(くる病・骨軟化症の診断マニュアル)
(日本内分泌学会,日本骨代謝学会,厚生労働省難治性疾患克服研究事業 ホルモン受容機構異常に関する調査研究班.日本内分泌学会雑誌.2015; 91 (Suppl.November) : 1-11.)
XLHの診断において,鑑別すべき最も主要な疾患はビタミンD欠乏性くる病である。このため,他施設から当施設への紹介時には,ビタミンD欠乏性くる病を除外後に診断依頼をする施設もあるが,鑑別困難として診断依頼する施設もある。実臨床では,ビタミンD欠乏性くる病・骨軟化症と診断して,活性型ビタミンD₃製剤を投与しても,症状改善がみられない場合には,XLHを疑われることもある。また,XLHで見落とされがちな所見として,歯牙の異常があげられ,患者は齲歯に罹患しやすい6)。
低リン血症性くる病・骨軟化症では,表11)に示すように,XLH以外に常染色体上の遺伝子異常に基づく,常染色体優性低リン血症性くる病 (autosomal dominant hypophosphatemic rickets osteomalacia:ADHR) などが存在するが,わが国では2〜3家系に限られており,患者のほとんどはXLHである。ただし,遺伝子解析が可能な施設は全国で数施設と限られている。
小児XLHの従来療法とその課題
上述のように,XLHの診断ではビタミンD欠乏性くる病との鑑別が重要である。これは,ビタミンD欠乏性くる病では活性型ビタミンD₃製剤で治療するのに対し,XLHでは経口リン製剤と活性型ビタミンD₃製剤との併用療法が必要なためである。
XLHの従来療法である経口リン製剤と活性型ビタミンD₃製剤の併用療法では,施設によって標準投与量が定められていることが多く,標準量を投与して改善の有無を確認しながら治療を進めて行くことになる。ただし,ビタミンD欠乏性くる病の病因はビタミンDの欠乏であるため,活性型ビタミンD₃製剤で根治に至るのに対し,XLHは,従来療法ではFGF23過剰という病因に対する治療ではないため根治には至らない。さらに,リンの補充はFGF23の活性を亢進させるため,血清リン濃度が低下することも従来療法の効果に影響していると考えられる。また,血清リン濃度は日内変動が大きく,リンが過剰か否かの判定は困難である。そのため,血清副甲状腺ホルモン (PTH) を測定し,PTHが上昇した場合に,リン投与過剰と判定することになる。
従来療法の効果が不十分な場合には投与量を漸増するが,投与量の増加に伴い,腎石灰化,高カルシウム尿症,二次性副甲状腺機能亢進症,高カルシウム血症などの副作用発現の懸念が高まることになる7)。副作用発現抑制のためには,個々の患者における適量を見極め,さらに頻回の血清中および尿中のリンならびにカルシウムの測定が必要になる。また,従来療法は,1日3回以上の投与となることから,アドヒアランスについても配慮する必要がある。患者の保護者は低身長に対する懸念が強く,治療意欲が強いものの,アドヒアランス不良例を経験することも少なくない。また,リン製剤は酸味が感じられることも,アドヒアランスに影響する可能性がある。
従来療法では,上述のような副作用が認められるほか,リン製剤の投与により血清FGF23がさらに上昇することも考えられるため病勢が進行する可能性がある8)。このため,XLHの重症度にもよるが,従来療法の治療満足度が必ずしも高くない患者も存在するものと推定される。
このほか,現行の治療方法として手術療法が考慮されることがあるが,成長期には下肢の変形が進むことが多いため,変形がある程度落ち着く成人後に施行することが一般的である。手術療法により下肢の痛み,脚の変形,歩様などは改善されるが,根治療法ではないため,骨軟化症の症状である易骨折性や痛みの再発がみられることはある。
さらに,思春期以降の患者は小児科から内科あるいは整形外科に移行するが,従来は医療者もXLHに対する認識が高くないことや,従来療法の必要性が,成長期に比べ成人期では大きくないこともあり,成長とともに受診・治療を中止する例も少なくなかった。XLHは,成人になってもFGF23の作用過剰という点は変わらないので,低リン血症に伴う症状は持続することも多い。
抗FGF23抗体製剤の登場―XLHに対する有用性
2018年に抗FGF23抗体製剤であるBurosumabが,XLHの治療薬として,欧州委員会 (European Commission) および米国食品医薬品局 (FDA) から相次いで医薬品販売承認を取得した。わが国においても,現在製造承認申請中である※2。Burosumabは,FGF23の中和抗体として作用することにより,腎におけるリンの再吸収を増加させるとともにリン排出を抑制し,さらに,腸管においてリンとカルシウムの吸収を促進する1,25 (OH)₂Dの産生を増加させることにより9),XLHに対する治療効果が期待できる。Burosumabは,従来療法では得られなかった,根治療法としての可能性が注目される。
Burosumabの有用性を検討するため実施された海外第Ⅱ相オープンラベル試験10)では,小児患者52例を2週ごとおよび4週ごとにBurosumabを皮下投与する2群に1:1の比率でランダムに割り付け,Thacherくる病重症度総スコアの変化量,X線所見の変化の全般的印象 (RGI-C) スケールの変化を,ベースライン,40週時,64週時に評価して検討された。その結果,Thacherくる病重症度総スコアの平均は,2週ごと投与群ではベースラインの1.9点から40週時点には0.8点に低下し,4週ごと投与群ではベースラインの1.7点から40週時点には1.1点に低下した(図3:いずれもp<0.001)。これらの改善は,64週時まで持続していた。血清リン値の平均は両群とも初回投与後に上昇し,いずれも半数以上が6週までに基準範囲内となった。2週ごと投与群では安定した血清リン値が64週まで持続した。腎尿細管でのリン酸再吸収量は,両群ともベースラインから増加し,全体の平均増加量は0.98mg/dLであった。40週時のBurosumab投与量の平均は,2週ごと投与群で0.98mg/kg,4週ごと投与群では1.50mg/kgであった。有害事象については,ほぼすべてが軽症または中等症であった。
※2:ブロスマブ 2019年12月6日発売
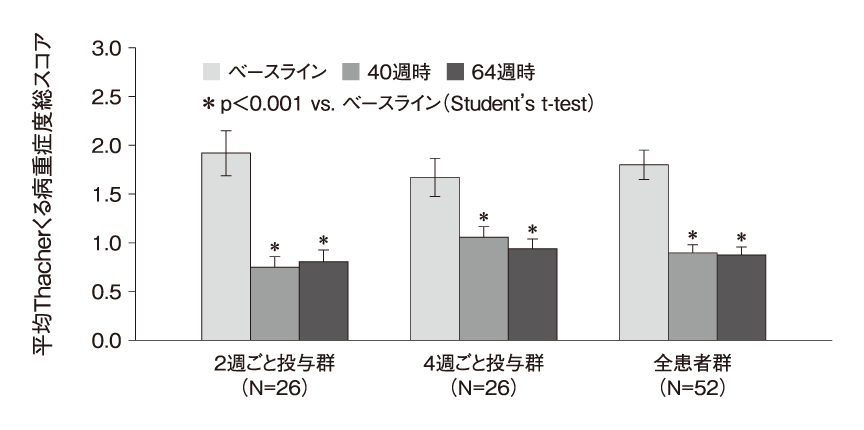
図3 Burosumabの第Ⅱ相臨床試験の結果(小児XLH患者)
Reproduced with permission from (scientific reference citation) , Copyright Massachusetts Medical Society. (Carpenter TO, et al. N Engl J Med. 2018; 378 : 1987-8.)
抗FGF23抗体製剤によるXLH治療の課題
近年,FDF23は腎におけるリン再吸収作用以外にも副甲状腺などの複数の臓器で作用すると考えられるようになっており,また生体には必須のホルモンであることも事実である。このため,FGF23の完全な抑制は何らかの有害事象を引き起こさせる懸念はあるが,Burosumabは中和抗体であることから,完全な抑制には至らないと考えられるため,重篤な有害事象発現の恐れは低いと考えられる。FGF23の作用障害による高リン酸血症の懸念もあるが,頻度は少ないと報告されている11)。
海外第Ⅱ相試験では,くる病重症度スコアの改善がみられたが10),今後さらなる長期の検討によって,成長の確保(低身長の回避)や骨変化の抑制などを検討するとともに,従来療法でみられる腎石灰化リスクも評価する必要があるだろう。また,Burosumabも遺伝子変異そのものを改変するものではないため,どの程度長期に投与する必要があるのかも検討すべきである。これらの点については,すでに欧米で承認されていることから,実臨床における有効性と安全性について,欧米からの報告に注目することが重要である。
また,従来療法で十分に改善する患者もみられることから,Burosumabと従来療法との使い分けや,従来療法からの切り替えについても検討する必要がある。
おわりに
XLHの臨床においては,まず患者の発見が重要である。ビタミンD欠乏性くる病として治療を進めている際,治療効果が不十分であると思われる場合には,FGF23関連低リン血症性疾患を疑うことを勧めたい。なお,FGF23関連低リン血症性疾患の診断では,血清FGF23測定の有用性が高い。
現在,XLH小児患者に対するBurosumabの有用性を検討した2つの第Ⅲ相臨床試験が進行中である12, 13)。これら試験の報告により,Burosumabのよりよい使い方が示されることを期待している。
- 木下祐加.FGF23とリン代謝調節.THE BONE. 2016; 30 : 367-73.
- Francis F, Hennig S, Korn B, et al. A gene (PEX) with homologies to endopeptidases is mutated in patients with X-linked hypophosphatemic rickets. Nat Genet. 1995; 11 : 130-6.
- 古家美菜絵,伊東伸朗.TIO (tumor-induced osteomalacia) の診断.Clinical Calcium. 2018; 28 : 1351-7.
- Endo I, Fukumoto S, Ozono K, et al. Nationwide survey of fibroblast growth factor 23 (FGF23)-related hypophosphatemic diseases in Japan: prevalence, biochemical data and treatment. Endocr J. 2015; 62 : 811-6.
- 日本内分泌学会,日本骨代謝学会,厚生労働省難治性疾患克服研究事業 ホルモン受容機構異常に関する調査研究班.くる病・骨軟化症の診断マニュアル.日本内分泌学会雑誌.2015; 91 (Suppl.November) : 1-11.
- 道上敏美.X染色体性低リン血症性骨軟化症.日内会誌.2007; 96 : 725-30.
- Carpenter TO, Imel EA, Holm IA, et al. A clinician's guide to X-linked hypophosphatemia. J Bone Miner Res. 2011; 26 : 1381-8.
- 道上敏美.低リン血症性くる病とFGF23. THE BONE. 2016; 30 : 361-6.
- Lyseng-Williamson KA. Burosumab in X-linked hypophosphatemia: a profile of its use in the USA. Drugs Ther Perspect. 2018; 34 : 497-506.
- Carpenter TO, Whyte MP, Imel EA, et al. Burosumab Therapy in Children with X-Linked Hypophosphatemia. N Engl J Med. 2018; 378 : 1987-8.
- 木下祐加.Clinical Calcium. 2018; 28 : 1373-9.
- NCT03233126 (https://clinicaltrials.gov/ct2/show/NCT03233126).
- NCT02915705 (https://clinicaltrials.gov/ct2/show/NCT02915705).

