X染色体優性低リン血症(XLH)と腫瘍性骨軟化症(TIO)の現状と抗FGF23抗体療法 ―成人患者について―
Pharma Medica 37(2):85-89, 2019
はじめに
線維芽細胞増殖因子23(fibroblast growth factor:FGF23)は骨から分泌され血清リン濃度を調節するホルモンであるが,何らかの原因により作用が過剰になることで,FGF23関連低リン血症性くる病・骨軟化症を惹起する。FGF23関連低リン血症性くる病・骨軟化症は,先天性疾患と後天性疾患に大別される。先天性疾患であるX染色体優性低リン血症(X-linked hypophosphatemia:XLH)に対する治療薬として,抗FGF23抗体であるburosumabが2018年に欧米で承認され,日本でも希少疾病用医薬品(オーファンドラッグ)に指定された。
本稿では,成人期のXLHおよび腫瘍性骨軟化症(tumor-induced osteomalacia:TIO)の現状と,新規治療薬として注目されている抗FGF23抗体について概説する。
XLHとTIOの原因および疫学
XLHおよびTIOは,FGF23の産生亢進あるいは作用過剰による低リン血症(図1)1)により惹起される疾患である。先天性のFGF23関連低リン血症の中で最も頻度の高いXLHは,phosphate-regulating endopeptidase homolog,X-linked(PHEX)遺伝子2)の変異を原因とする。一方,後天性疾患であるTIOでは,骨や軟部組織等に発生した腫瘍(phosphaturic mesenchymal tumor, mixed connective tissue variant:PMTMCT)3)からFGF23が異所性に過剰産生されるが,その詳細な機序はわかっていない。
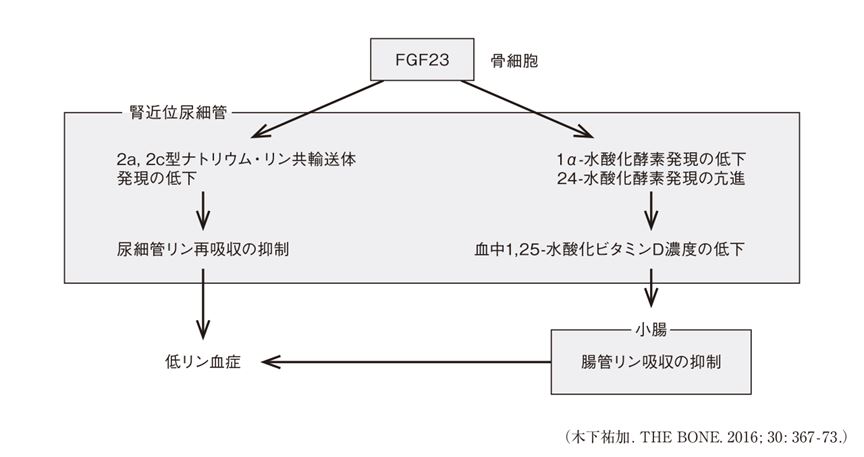
図1 FGF23作用過剰による低リン血症の機序
2010年に実施された全国疫学調査4)では,FGF23関連低リン血症性くる病・骨軟化症全体の年間発症例数は推定117例で,XLHのみの推定発症率は2万人に1人であった。また,TIOの有病率は1/1~5万人程度と予想されている5)。
近年,FGF23関連低リン血症性くる病・骨軟化症がより広く認知されるようになったためか,特にTIOと診断される症例が増えているように感じている。一方で,TIOは骨痛や骨折,筋力低下といった症状から,10年を超える長期にわたって別の疾患と診断されている患者も存在する。誤診断例として,椎間板ヘルニアや強直性脊椎炎といった腰椎や脊椎の疾患をはじめ,骨粗鬆症,関節リウマチ等が報告されている6)。一方で,遺伝性疾患であるXLHは,ほとんどの症例が乳幼児期に診断に至っている。
TIOの課題 ―早期診断―
TIOの診断では,まず骨軟化症という疾患を念頭において患者を診察することが重要である。易骨折性をきたす患者で,採血で低リン血症と高アルカリホスファターゼ(ALP)血症の存在が確認できれば,骨軟化症の可能性を考えて精査を進める。くる病・骨軟化症の診断基準を満たし,低リン血症に加えて血清FGF23値が30pg/mL以上であれば,FGF23関連低リン血症性くる病・骨軟化症と診断できる(図2)7)。さらに,病歴から成人発症であることがわかれば,TIOの可能性が高い。一般的な血清FGF23の基準値は10-50pg/mLとされているが,通常,血清リン濃度の低下に伴いFGF23は感度未満まで低下する。慢性的な低リン血症があるにもかかわらずFGF23が高いまま維持されていれば,FGF23関連低リン血症と推測される。なお,血清FGF23値とTIOの重症度の相関は報告されておらず,FGF23作用が少しでも過剰であれば,低リン血症とそれに伴う骨合併症をきたす可能性がある。
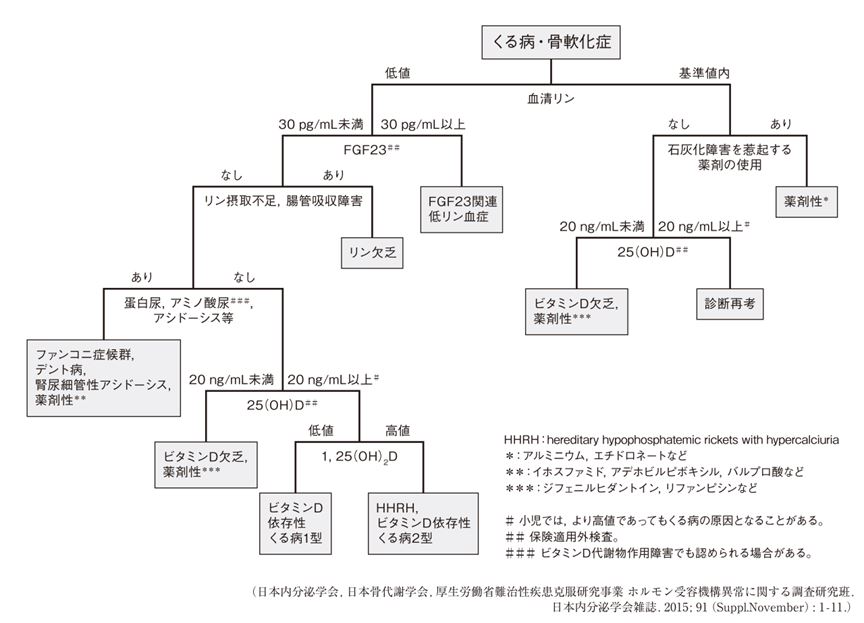
図2 くる病・骨軟化症の病因鑑別フローチャート(くる病・骨軟化症の診断マニュアル)
TIOを診断する上で低リン血症の存在は必須であるが,一般臨床の場では血清リン濃度はあまり測定されていない。血清リン濃度が測定され,低リン血症が認められた場合でも,その原因が栄養失調によるとされ,骨疾患との関連が想起されないことも多い。また,TIOでは血中ALP濃度も上昇するが,ALPは肝機能障害時にも上昇するため,骨が原因であることに気づかれない場合もある。血清リン濃度の測定に加え,骨軟化症にみられる代表的な検査所見を理解しておくことが重要である。
成人期に診断に至るFGF23関連低リン血症の多くはTIOであり,そのような症例では原因腫瘍の発見に重点を置いて診断と治療を進めていく。原因腫瘍は微小な場合があり,また発生部位が全身にわたるため,局在診断に難渋することが多い。当院では,ソマトスタチン受容体シンチグラフィをはじめとした画像検査と,FGF23全身静脈サンプリング検査を併用する方法で,腫瘍の局在診断を行っている。この診断方法により,当院では約8割の患者で原因腫瘍の同定に至っている8)。ただし,FGF23全身静脈サンプリング検査は2018年12月現在で保険適用ではなく,施設ごとに臨床研究という形で実施している。FGF23全身静脈サンプリング検査では腫瘍のホルモン分泌能を直接確認することができるため,一般的な画像検査と併用することで,局在診断をより確実に行うことが可能となる。この先,FGF23全身静脈サンプリング検査が保険適用になれば※1,より多くの症例の局在診断につながることが期待される。
※1:FGF23測定の保険適用 2019年10月
XLHの課題 ―成人患者における異所性石灰化―
XLHの成人患者では,小児期の治療の有無にかかわらず,石灰化を伴う腱・靱帯付着部症がしばしば認められる9)。後縦靱帯骨化症(ossification of posterior longitudinal ligament:OPLL)や黄色靱帯骨化症(ossification of the ligamentum flavum:OLF)等により,上下肢の筋力低下やしびれなどの神経症状が出現し,QOLが低下している患者も多い。しかし,XLHにおける異所性石灰化の発症機序は明らかにされておらず,外科手術以外の治療法も確立されていない。
XLHおよびTIOの現行治療
TIO患者において原因腫瘍が特定された場合には,基本的には腫瘍の外科的摘除を行う。腫瘍が完全に摘除できれば低リン血症や骨合併症の改善が期待される。一方で,腫瘍の残存により症状が続く患者や,手術の数年後に症状が再燃する患者が1~2割程度みられる。
現在,XLHとTIO(腫瘍摘除を除く)に対する根本的治療はなく,活性型ビタミンD製剤とリン製剤の内服による対症療法が基本である。ただし,多くの症例で血清リン濃度の正常化には至らず4),また小児期の骨変形に伴う症状は改善しないため,患者満足度は決して高いとはいえない。一方で,これらの内服薬により痛みや筋力低下が改善し,ADLが大きく向上する患者もみられる。
安全性の面では,従来治療の長期的な副作用として,続発性副甲状腺機能亢進症,高カルシウム血症,腎石灰化,慢性腎臓病(CKD)等が問題になっている9)。特に,リン製剤のみでは続発性副甲状腺機能亢進症を起こしやすいとされており,活性型ビタミンD製剤との併用が一般的である。
また,リン製剤は投与回数も課題となる。活性型ビタミンD製剤は1日1回投与であるが,リン製剤は1日複数回投与することが多い。XLHやTIOでは尿中へのリン排泄が亢進しており,血中リン濃度を維持するにはリン製剤は頻回投与が望ましい。ただし,アドヒアランスの面から現実的には1日2-3回の分割投与となることが多い。XLHやTIOに対するリン製剤の投与量は確立しておらず,個々の症例に応じて適正量を検討する必要がある。臨床試験のように測定時間や服薬条件等を一定にすることは,一般外来では困難であり,外来での血清リン濃度はあくまで参考所見となる。そのため,血清リン濃度だけではなく,臨床症状や血清ALP濃度の変化をみながら投与量を調節する。また,合併症の出現に注意すべく,副甲状腺ホルモン(PTH)や尿中カルシウムの上昇にも留意する。
抗FGF23抗体への期待と課題
2018年,欧米で抗FGF23抗体製剤であるBurosumabが,XLHを適応症として製造販売が承認された。XLHの成人に対する国際共同第III相試験10),および長期試験11)も結果が公表されている。TIOに対しては現在第II相試験中12)である。日本では,2018年5月にFGF23関連低リン血症性くる病・骨軟化症を適応として希少疾病用医薬品,いわゆるオーファンドラッグに指定された。近い将来,日本でも製造販売が承認されることが予想される※2。
XLHの成人に対する無作為化二重盲検プラセボ対照比較試験である第III相試験10)では,主要評価項目である平均血清リン濃度(投与間隔中間時点)の標準下限(lower limit of normal:LLN)を上回る患者割合がBurosumab群94.1%に対し,プラセボ群7.6%と有意に増加した(p<0.001)。また,血清リン濃度に加え,Western Ontario and McMaster Universities Osteoarthritis Index(WOMAC)なども改善が認められた(図3)。一方で,血清intact-PTHや尿中カルシウム濃度はベースラインからの有意な変化は認められなかった(図3)。
※2:ブロスマブ 2019年12月6日発売
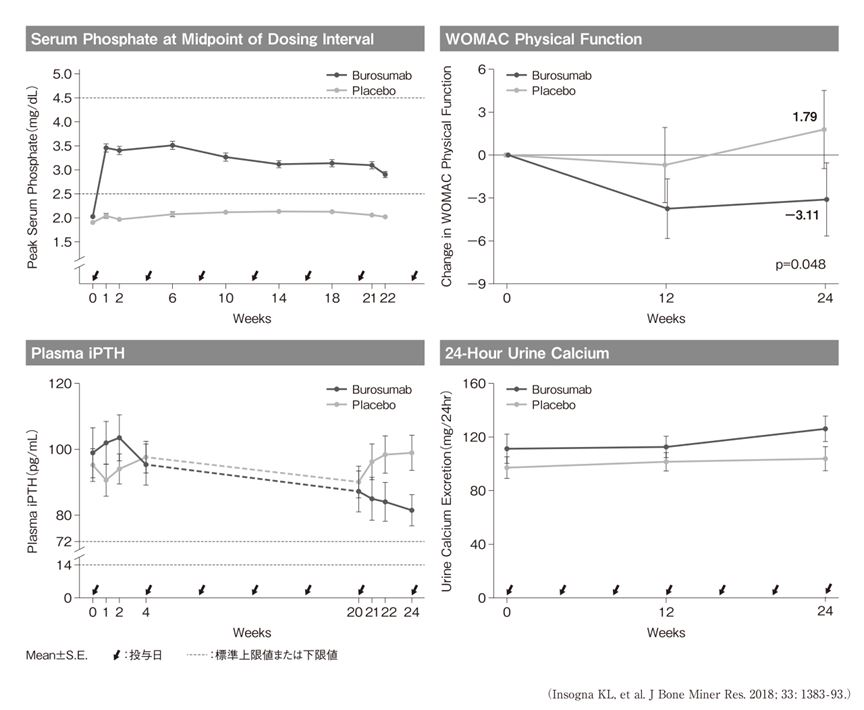
図3 burosumabの第III相試験結果(XLH成人)
小児のXLHに対するBurosumabの第II相試験13)および第III相試験14)でも,くる病所見や血清リン濃度等の改善が報告されており,骨変形をきたす前の小児期に抗FGF23抗体治療を開始することで十分な効果を示せれば,多くの症例でQOLやADLは向上すると思われる。ただし,併発するOPLLや末梢の腱・靱帯の異所性石灰化に関して,小児期からの抗FGF23抗体治療によりどの程度予防できるかは,今後の検討課題である。
また,抗FGF23抗体治療により,経口リン製剤でみられた合併症を回避できるかどうかも注目すべき点である。内服のリン製剤では,内服後の急激な血清リン濃度の上昇は避けられず,それが続発性副甲状腺機能亢進症の発症に影響する可能性がある。抗FGF23抗体治療では,血清リン濃度の日内変動は穏やかになると予想され,それにより続発性副甲状腺機能亢進症の発症を抑制できる可能性がある。
抗FGF23抗体は月1回(小児は月2回)の皮下注射であることから,アドヒアランスの面では優れているといえる。ただし,現行治療に比べて受診回数は増える可能性が高く,患者によっては負担に感じるかもしれない。投与方法については,将来的に自己注射の可能性も含め検討の余地がある。
安全性の面では,FGF23作用抑制が過剰になった場合,FGF23作用障害による高リン血症性疾患でみられるような合併症の懸念がある。新規作用機序の薬剤であるため,未知の副作用が発現する可能性を考えておく必要がある。現時点までの臨床試験では,重度の高リン血症や続発性副甲状腺機能亢進症に関連するような副作用は報告されていない10, 13, 14)。
以上より,従来の治療と比較して抗FGF23抗体の有用性が期待されるものの,患者が治療効果に対して過剰な期待を持つような情報提供は避けるべきと考える。特に成人患者で,すでに骨変形が進行してしまった場合など,自覚症状がどの程度改善できるかは未知数である。抗FGF23抗体により病状の改善が期待される症例を判断して使用する必要がある。
おわりに
低リン血症による骨脆弱性疾患としてXLH,TIOが広く認識されることにより,早期に診断・治療に至る症例が増えることが期待される。また,FGF23関連低リン血症性疾患に対する新たな治療法として抗FGF23抗体が開発されたことから,これまで対症療法が中心であったXLHおよび外科的治療が困難なTIOに対する有効性が期待される。
- 木下祐加.FGF23とリン代謝調節.THE BONE. 2016; 30: 367-73.
- The HYP Consortium. A gene (PEX) with homologies to endopeptidases is mutated in patients with X-linked hypophosphatemic rickets. Nat Genet. 1995; 11: 130-6.
- Folpe AL, Fanburg-Smith JC, Billings SD, et al. Most osteomalacia-associated mesenchymal tumors are a single histopathologic entity: an analysis of 32 cases and a comprehensive review of the literature. Am J Surg Pathol. 2004; 28: 1-30.
- Endo I, Fukumoto S, Ozono K, et al. Nationwide survey of fibroblast growth factor 23 (FGF23)-related hypophosphatemic diseases in Japan: prevalence, biochemical data and treatment. Endocr J. 2015; 62: 811-6.
- 古家美菜絵,伊東伸朗.TIO (tumor-induced osteomalacia) の診断. Clinical Calcium. 2018; 28: 1351-7.
- Feng J, Jiang Y, Wang O, et al. The diagnostic dilemma of tumor induced osteomalacia: a retrospective analysis of 144 cases. Endocr J. 2017; 64: 675-83.
- 日本内分泌学会,日本骨代謝学会,厚生労働省難治性疾患克服研究事業 ホルモン受容機構異常に関する調査研究班.くる病・骨軟化症の診断マニュアル.日本内分泌学会雑誌.2015; 91 (Suppl.November): 1-11.
- Ito N, Shimizu Y, Suzuki H, et al. Clinical utility of systemic venous sampling of FGF23 for identifying tumours responsible for tumour-induced osteomalacia. J Intern Med. 2010; 268: 390-4.
- Carpenter TO, Imel EA, Holm IA, et al. A Clinician's Guide to X-linked Hypophosphatemia. J Bone Miner Res. 2011; 26: 1381-8.
- Insogna KL, Briot K, Imel EA, et al. A Randomized, Double-Blind, Placebo-Controlled, Phase 3 Trial Evaluating the Efficacy of Burosumab, an Anti-FGF23 Antibody, in Adults With X-Linked Hypophosphatemia: Week 24 Primary Analysis. J Bone Miner Res. 2018; 33: 1383-93.
- ClinicalTrials.gov. NCT02537431. https://clinicaltrials.gov/ct2/show/NCT02537431(2018年12月現在)
- ClinicalTrials.gov. NCT02722798. https://clinicaltrials.gov/ct2/show/NCT02722798(2018年12月現在)
- Carpenter TO, Whyte MP, Imel EA, et al. Burosumab Therapy in Children with X-Linked Hypophosphatemia. N Engl J Med. 2018; 378: 1987-98.
- 協和発酵キリン.ニュースリリース.ブロスマブの小児X染色体遺伝性低リン血症を対象とした第3相臨床試験結果について.2018年5月17日.https://www.kyowa-kirin.co.jp/news_releases/2018/20180517_01.html(2018年12月現在)

